1. Themenfeld A: Gewinnung, Speicherung und Nutzung elektrischer Energie in der Chemie
2. Themenfeld C: Analytische Verfahren zur Konzentrationsbestimmung
3. Themenfeld B: Reaktionswege zur Herstellung von Stoffen in der organische Chemie
Im Themenfeld C gibt es eine Reihe von Anknüpfungspunkten zum Themenfeld A, während Themenfeld B wiederum einige Überschneidungen zum Konzept der Jahrgangstufe 13 (Theoriekonzept - Themenfeld) bietet.
Zeitvolumen: 38 Wochen*3h/Woche= 114 h, davon 80% = 91 h
Für jedes Themenfeld steht damit ein Volumen von 30 Stunden=10 Wochen zur Verfügung.
Datenblätter für Stoffgruppen
Diagramme
Folien
Klausuren
Lern- und methodische Hinweise
Referate
Texte
Übungsaufgaben
Versuche und -ergebnisse
Hinweise zum Ausdrucken
Themenfeld A: Gewinnung, Speicherung und Nutzung elektrischer Energie in der Chemie
Unterrichtsreihe: Themen - Unterthemen
►Gleichsetzung der Oxidationsreaktion von Metallen mit der Reaktion Metall - anderes Nichtmetall
►Oxidation-Reduktion als Elektronentransfer
Reaktion Mg + O2
Reaktion Mg + Cl2
Tausch 2000+/Bd 2: 6, 7
►Zn, Fe, Cu und Ag in den Salzlösungen der entsprechenden Metalle
►qualitative Interpretation der Ergebnisse: Hierarchie der Oxidationskraft von Metallionen <–> Reduktionskraft von Metallatomen
►qualitative Redoxreihe
Kombination von 4 Metallen mit ihren Salzlösungen (opt: SV)
Tausch 2000+/Bd 2: 10, 11
►Begriff der galvanischen Zelle: Akzeptor- und Donator-Halbzelle
►Entstehung der Potenzialdifferenz
►elektrochemische Doppelschicht
Zitronenbatterie
Daniell-Element aus Cu+Zn
Tausch 2000+/Bd 2: 12, 13
►Wiederholung der Kombination erfolgreicher Redoxreaktionen auf quantitative Weise
►Additivität der Spannungen
►Zellendiagramm
►Begriff des Redoxpotenzials
Elektrochemie-Baukasten:
Redoxreaktionen von Zn–> Ag
als Schülerversuche
Tausch 2000+/Bd 2: 14, 15
Schroedel-SII: S. 140, 141
►Ableitung der Notwendigkeit eines Vergleichs- oder Bezugssystems aus dem vorherigen Thema
►Aufbau und Wirkungsweise der Standard-Wasserstoff-Elektrode
►Definition des Standard-Redoxpotentials
V2 und V3 aus Tausch
Tausch 2000+/Bd 2: 22, 23
Schroedel-SII: S. 143, 144
►Einfluss der Konzentration auf das Potenzial
►qualitative Ableitung der Nernst-Beziehung
►quantitative Herleitung der Nernst-Gleichung in der einfachsten Form: U = EA - ED = 0,059/z * lg{cA(Me+)/cD(Me+)}
►Berechnungen und Übungen zu dieser einfachsten Form der Nernst-Gleichung
V1 und V3 aus Tausch
Tausch 2000+/Bd 2: 32, 33
Schroedel-SII: S. 143
►Die Taschenlampenbatterie: das Leclanche-Element
►Primär- und Sekundärreaktionen
opt: SV: Zerlegung einer Taschenlampenbatterie
Tausch 2000+/Bd 2: 44, 45
Tausch 2000+/Bd 2: 46
Schroedel-SII: S. 158, 159
►Der Blei-Akku (obligatorisch)
alternativ:
►Ni-MeH-Akku (zusätzlich, wenn Zeit!)
Stein: S. 86ff, S. 89ff,
Tausch 2000+/Bd 2: 50
Schroedel-SII: S. 161, 162,
►Elektrolyse von Wasser oder (alternativ) Salzsäure
►Faraday-Gesetze in vereinfachter Form: einfach quantitative Beziehungen ohne Sekundärreaktionen
►Elektrolyse von wässrigen Lösungen von CuCl2, ZnBr2,
►Al-Gewinnung durch Schmelzflusselektrolyse
Tausch 2000+/Bd 2: 18,
Schroedel-SII: S. 171-173, 176-177
Stein: S. 51ff
Themenfeld C: Analytische Verfahren zur Konzentrationsbestimmung
Essigsäure-NaOH, Zitronensaft-NaOH, Schwefelsre-NaOH
Tausch Chemie2000+, Bd.2
Versuche+Theorie S. 68/69
Leitfähigkeitsmessung HCl(g) in Wasser, Toluol, Methanol
Leitfähigkeitsmessung NH3(g) in Wasser, Toluol, Methanol
Versuche +Theorie S. 70/71
Tausch/v. Wachtendonk: Protolyse-Gleichgewichte Bd. 1, Aulis-Verlag: Baustein 1
AB 1 und 2, AB 3 als Übung
Konjugierte Säure-Basen-Paare
Salzprotolysen
Überblick zu Brönsted-Säuren und -Basen
Konjugierte Säure-Basen-Paare
Salzprotolysen
Überblick zu Brönsted-Säuren und -Basen
Definition des pH-Werts
Berechnung von pH-Werten starker, mittelstarker und schwacher Säuren
Versuche+Theorie S. 82/83; 86, 87;
Tausch/v. Wachtendonk: Protolyse-Gleichgewichte Bd. 1, Aulis-Verlag: Baustein 3
Versuche +Theorie S. 84/85
Tausch/v. Wachtendonk: Protolyse-Gleichgewichte Bd. 1, Aulis-Verlag: Baustein 4
Tausch Chemie2000+, Bd.2
Versuche +Theorie S. 38/39
Tausch/v. Wachtendonk: Protolyse-Gleichgewichte Bd. 1, Aulis-Verlag: Baustein 7
HCl-NaOH, Ba(OH)2-H2SO4, CH3COOH-NaOH
Tausch Chemie2000+, Bd.2
Versuche +Theorie S. 76+77
Tausch/v. Wachtendonk: Protolyse-Gleichgewichte Bd. 1, Aulis-Verlag: Baustein 7
Themenfeld B: Reaktionswege zur Herstellung von Stoffen in der organischen Chemie
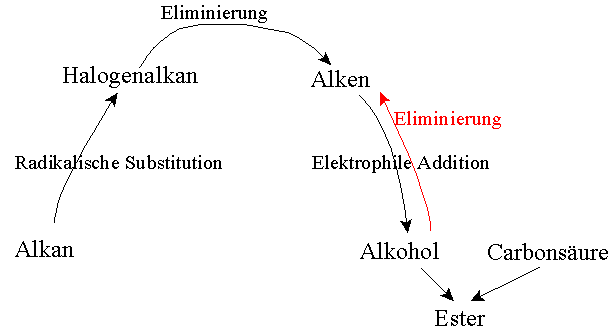
=photochemische Halogenierung; Start-, Ketten- und Abbruchreaktion; Radikalkettenmechanismus; Ausgangsstoffe-Tradukt (Übergangszustand)-Endprodukt;
Tausch/v. Wachtendonk: Chemie 2000+ Band 2, S. 106, S. 108 und 109
Tausch/v. Wachtendonk: S. 107, S. 113
Tausch/v. Wachtendonk: Chemie 2000+ Band 2, S. 114, 115, 116-117
Tausch/v. Wachtendonk: Chemie 2000+ Band 2, S. 120; 121;
Hydrolyse-Reaktion; Leitfähigkeitsmessungen, Hydrolyse-Reaktionen in Abhängigkeit von der Struktur: SN1 und SN2; Einfluss der Struktur, des Substrats, der Abgangsgruppe und des LM auf den RM, Kinetik der Reaktionen 1. und 2. Ordnung; RM der SN-Reaktion: monomolekular oder bimolekular; Zeitgesetze in verschiedenen Formen: differentiell oder integriert;
S. 138 + 139
Anknüpfung und Wiederholung aus der 11. Jahrgangsstufe