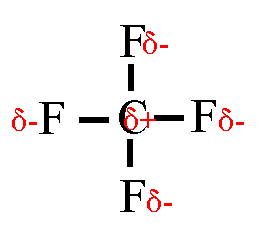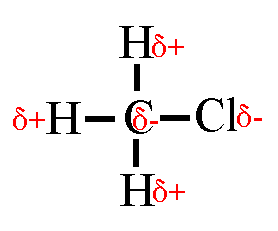|
||||||||||||||||||||||||||||||||||||||||
Übung zu intra- und intermolekularen Bindungskräften (I) |
||||||||||||||||||||||||||||||||||||||||
|
Arbeitsauftrag: Bearbeite
schriftlich folgende Fragen und Aufgaben!
1. Welche Anziehungskräfte wirken zwischen den Molekülen den flüssigen Broms? 2. Warum weist Fluor eine niedrigere Siedetemperatur als Brom auf? 3. Zwischen welchen der folgenden Moleküle können
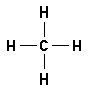
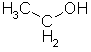
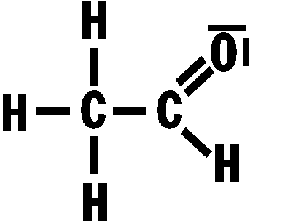
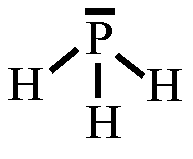
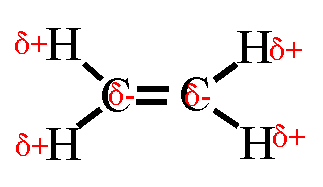
Wasserstoffbrückenbindungen gebildet werden: 4. Gib die Strukturformeln folgender Moleküle an: a) H2S, b) CF4, c) PH3 d) CHCl3
e) C2H4
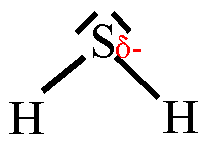
5. Trage in die Strukturformeln die Teilladungen der Atome ein! Welche
dieser Moleküle sind Dipole? 6. Ordne folgende Bindungen nach steigender Polarität: Cl-H, O-H, C-H, F-H, Br-H 7. Ordne die Siedetemperaturen [in °C] -269, -196, -183, -85, -67, 19
folgenden Stoffen zu: 8. Begründe: Warum liegt die Siedetemperatur des Wassers höher als die des Fluorwasserstoffs, obwohl die Polarität der H-F-Bindung größer ist als die der O-H-Bindung? 9. Ordne ein:
|