|
1. Tabellarische
Zusammenfassung:
|
V-Nr. |
Versuchsbedingungen |
Versuchsergebnisse |
|
1. |
Ethen + Bromwasser, Br2(aq) |
- schnelle Entfärbung
- saure Reaktion
- Bildung von AgBr(s) |
|
2. |
Ethen + Br2(PER) |
keine Entfärbung: keine Reaktion |
|
3. |
Br2(aq) in a) Hexen
b) Cyclohexen
c) PER |
langsamere Reaktion in a) und b) als V1,
saure Reaktion, AgBr-Bildung
in c) keine Reaktion |
|
4. |
Br2(PER) in a) Hexen
b) Cyclohexen |
langsame Entfärbung
keine saure Reaktion |
|
5. |
a) Propen + Hbr
b) 2-Methyl-propen + HBr |
–> 2-Brom-propan, wenig 1-Brom-propan
–> 2-Brom-2-methyl-propan, wenig
1-Brom-2-methyl-propan |
2. Elektrophile
Addition von Halogenen
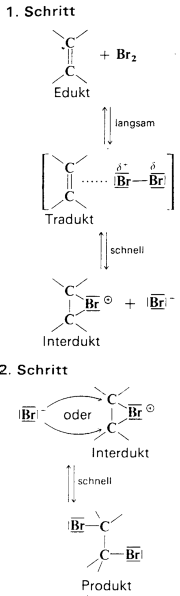 |
1. Schritt:
In einem Brom-Molekül, das sich der
C=C-Doppelbindung des Alkens nähert, findet eine Polarisierung statt, d.h.
das Bindungselektronenpaar verschiebt sich in der Weise, wie es in der
Abb. mit Hilfe der Partialladungen angedeutet ist: Br*+-
Br*-. Es kommt zur
Ausbildung einer Wechselwirkung zwischen dem Elektronenpaar aus der
Doppelbindung und dem positivierten Br-Atom im Brom-Molekül (sog. Tradukt,
von (lat). tra(ns)ducere, hinüberführen). Das Tradukt kann entweder in die
Ausgangsstoffe zerfallen (Rückreaktion) oder über eine Weiterreaktion in
ein Bromid-Anion und ein cyclisches Bromonium-Ion (Interdukt, interducere
(lat).: dazwischenführen) übergehen. Darin überbrückt das Brom-Atom die
ursprüngliche Doppelbindung und bildet mit den beiden C-Atomen einen
dreigliedrigen Ring (cyclischer Übergangszustand, in dem die positive
Ladung über drei Atome „verschmiert" ist).
2. Schritt:
Das abgespaltene Brom-Anion greift eines der
beiden C-Atom des Bromonium-Ions von der Rückseite aus an, die ja beide
eine positive Partialladung tragen und bildet damit eine
Elektronenpaarbindung aus. Gleichzeitig wird damit der cyclische Zustand
aufgehoben und das darin schon vorhandene Brom-Atom wird an das andere
C-Atom kovalent gebunden.
Erklärung der
Beobachtungen:
Da die Bromaddition über ionische Zwischenstufen
verläuft, ist die Reaktionsgeschwindigkeit in dem Lösungsmittel
größer, das ionische Zwischenstufen begünstigt, also in einem polaren LM
wie Wasser. Hier treten die LM-Moleküle mit den Ionen in
elektrostatische Wechselwirkung und stabilisieren deren Ladungen. Da bei
der Reaktion ein cyclisches Bromonium-Ion auftritt, kann dieses auch
durch andere nucleophile Teilchen als das Brom-Anion angegriffen werden,
z.B. durch das LM-Molekül Wasser selbst. In diesem Fall bildet sich über
ein Hydronium-Ion ein Bromalkohol und hydratisierte Protonen sowie
Brom-Anionen. Das erklärt die saure Reaktion und die Bildung des
AgBr-Niederschlags mit AgNO3(aq) (Konkurrenzreaktion zur
Brom-Addition)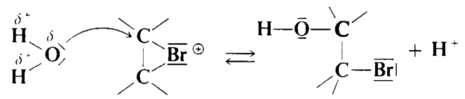 |
|
3. Rolle und Bedeutung
des LM:
Das LM unterstützt oder behindert die
Polarisierung des Agens durch die C=C-Doppelbindung und unterstützt oder
behindert die Ausbildung der ionischen Zwischenstufen Bromonium-Ion und
Brom-Anion. Ein polares LM wie Wasser mit positiven und negativen
Partialladungen unterstützt die Reaktion, ein unpolares, weil
symmetrisch aufgebautes LM wie PER unterstützt die Polarisierung nicht.
Deswegen ist PER trotz seiner Doppelbindung nicht fähig zur
Elektrophilen Addition (Versuch 3) und behindert in seiner Funktion als
LM die Addition von Brom (Versuch 4).
|
|
Versuch 4:
Die langsame Entfärbung von in PER gelöstem Brom(PER)
durch Hexen bzw. Cyclohexen liegt einerseits an der fehlenden
Polarisierung des Broms durch das PER und andererseits an der „Dämpfung"
der Elektronendichte der C=C-Doppelbindung durch die der C=C-Doppelbindung
benachbarten Alkylgruppen des Hexens und des Cyclohexens. Da kein Wasser
im Spiel ist, kann auch kein Hydronium-Ion entstehen.
|
|
4. Induktiver Effekt:
Die Übertragung einer
Bindungspolarisierung auch auf benachbarte Bindungen nennt man den
Induktiven Effekt. Substituenten, die durch ihre hohe Elektronegativität
einen Elektronensog auslösen, durch den sie selbst eine negative
Partialladung erhalten, üben einen -I-Effekt aus. Demgegenüber besitzen
Substituenten, die Elektronen schiebend auf die benachbarten Bindungen
wirken und damit die positive Partialladung erniedrigen, einen +I-Effekt
aus. Der +I-Effekt steigt in der Reihenfolge
C²CH3
< C
²CH2-CH3
< C²C(CH3)2
< C²C(CH3)3
²
stellt sowohl die Bindung als auch
die Richtung des I-Effektes
dar.
|
|
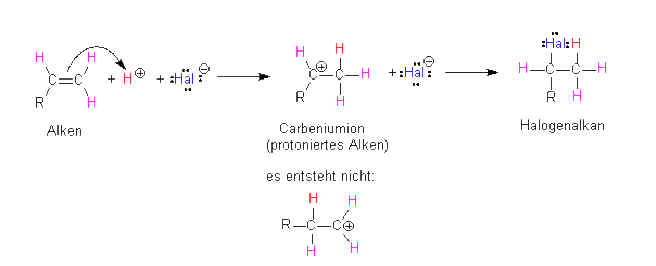
Versuch 5:
In diesem Fall bildet sich ein
nicht-cyclisches Carbokation, in dem die schwach polare
H-Br-Bindung durch die Doppelbindung direkt gespalten wird, sich
dieses Carbokation-=Carbeniumion ausbildet und im nächsten Schritt
das Anion addiert wird. Das H+-Ion lagert sich nun an
dasjenige C-Atom an, das schon mehr H-Atome trägt, so dass
möglichst viele Methylgruppen entstehen, |
 |
|
die das Carbenium-Ion
stabilisieren. Regel von Markownikow: (mit w oder ff
geschrieben): „Denn der hat, dem wird gegeben werden".
Übersetzt: dasjenige C-Atom,
das schon die meisten H-Atome gebunden hat, bekommt noch mehr,
weil dann mehr Alkylgruppen entstehen.
Im Falle von 2-Methyl-propen
entsteht ein 2-Methyl-propen-Carbenium-Ion, das mit drei
Methylgruppen die positive Ladung am zentralen C-Atom
stabilisiert, würde das H-Ion an das mittlere C-Atom gehen,
würden nur 2 Methyl- bzw. eine Isopropylgruppe das Carbenium-Ion
stabilisieren.
Siehe
auch
Lösungen zu den Aufgaben "Zum
Halogenalkan über Alkene"
im pdf-Format
und
Lösungen zu den
Aufgaben "Zum
Halogenalkan über Alkene"
im WordPerfect-Format |
|
|