|
||
Die Taschenlampen-Batterie nach Leclanché |
||
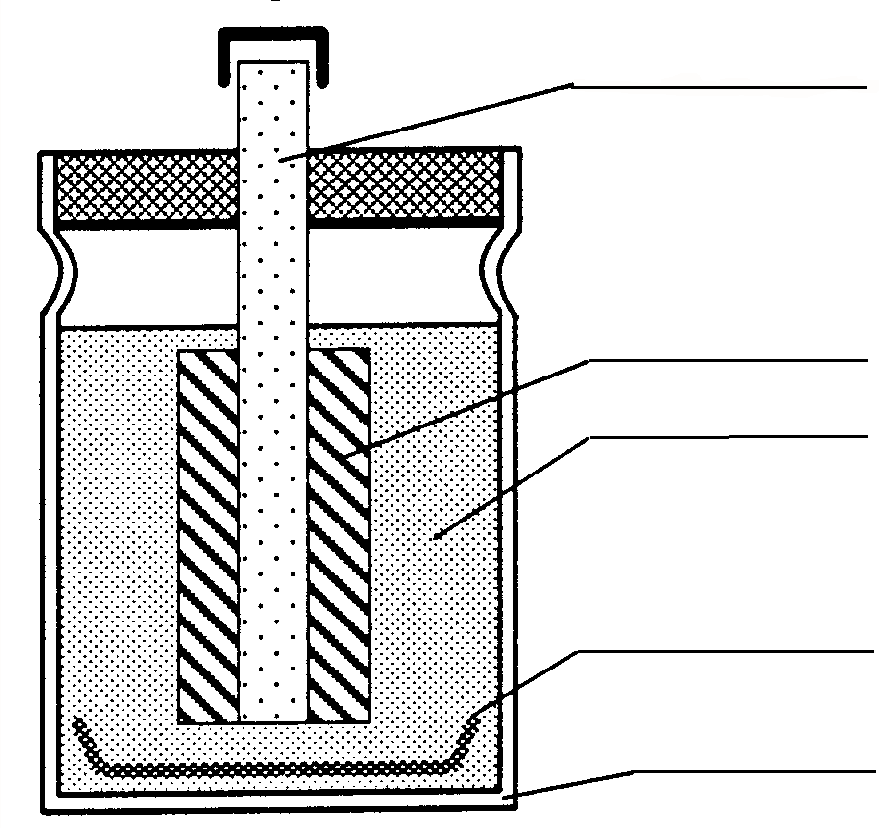
| Eine einfache Taschenlampenbatterie nach Leclanché ¹ besteht aus einem ______________als _________-Pol und einem ____________________ als ______ - Pol, der von einer feuchten Paste aus Mangan(IV)-oxid (Braunstein, Mangandioxid), Kohlepulver, Ammoniumchlorid und Stärke umgeben ist. Bei Stromfluss entstehen in diesem ______________________ Element an den Elektroden in den Primärreaktionen folgende Stoffe: Zink(II)-Ionen Zn2+(aq), Mangan(III)-oxidhydrat [(MnO OH)] und Ammoniak NH3(g). In Sekundärreaktionen bilden sich Zink-Amminkomplexe [Zn(NH3)2]2+, die als schwerlösliches Diamminzink(II)chlorid ausfallen. | ||
|
Bei fortgeschrittener Entladung der Zelle wird auch Zinkhydroxid gebildet, das zu Zinkoxid weiterreagiert. Aufgrund der Sekundärreaktionen ist das Leclanché-Element nicht wieder aufladbar. Arbeitsaufträge:1. Beschrifte die angegebenen Punkte in der Skizze. 2. Welche Funktion haben die Substanzen Zink, Mangandioxid=Braunstein, Kohlepulver, Ammoniumchlorid und Stärke? Zink:______________________________ MnO2:_____________________________ Kohlepulver: ________________________ Ammoniumchlorid NH4Cl: ____________ Stärke: _____________________________ |
 |
|
|
3. Formuliere die Reaktionsgleichungen für die Elektrodenreaktionen! Minus-Pol (Oxidation): ____________________________________________ Plus-Pol (Reduktion:) _____________________________________________ Gesamtreaktion: __________________________________________________ 4. Formuliere die Reaktionsgleichungen der beschriebenen Sekundärreaktionen. _____________________________________________________________ _____________________________________________________________ 5. Warum neigen ältere, verbrauchte Batterien zum Auslaufen? _____________________________________________________________ _____________________________________________________________ _____________________________________________________________ 6. Warum darf man ein solches Element nicht wieder aufladen? _____________________________________________________________ _____________________________________________________________ _____________________________________________________________ Der Franzose
Georges Leclanche´¹
(1839-1882) entwickelte im Jahre 1867 die nach ihm benannte
Batterie. |
||
|
Lösungen: |
| Lösungswörter
in der Reihenfolge ihrer Verwendung: Zinkbecher, Minus- , Kohlestab, Plus- , galvanischem, Arbeitsaufträge: 2.
Funktionen der Bestandteile: 3. Formuliere die Reaktionsgleichungen für die Elektrodenreaktionen! Minus-Pol: Zn(s) -----> Zn2+(aq) + 2 e¯ Plus-Pol: 2 MnO2(s) + 2 H2O(l) + 2 e¯ ----> 2 MnO(OH)(s) + 2 OH¯(aq) 2 NH4+(aq) + 2 OH¯(aq) ----> 2 NH3(g) + 2 H2O(l) Gesamtreaktion: Zn(s) + 2 MnO2(s) + 2 NH4+(aq) ---> Zn2+(aq) + 2 MnO(OH)(s) + 2 NH3(g) 4. Reaktionsgleichungen Sekundärreaktionen: Zn2+(aq) + 2 NH3(g) ---> [Zn(NH3)2]2+(aq) [Zn(NH3)2]2+(aq) + 2 Cl¯(aq) -----> [Zn(NH3)2]Cl2(s) : unlösliches Di-ammin-zink(II)-chlorid Zn2+(aq) + 2 OH¯(aq) ---> Zn(OH)2(s), das im weiteren Verlauf Wasser abspaltet: Zn(OH)2(s) ----> ZnO(s) + H2O(l) 5. Auslaufneigung: Das im letzten Schritt gebildete Wasser kann nicht wieder chemisch verwendet werden und greift den Stahlmantel der Batterie an, bei Undichtigkeit infolge von Korrosion läuft die Batterie aus. Ohne Stahlmantel läuft die Batterie schon viel früher aus, weil der Zinkmantel undicht wird. 6. Nichtwiederaufladbarkeit: Die Produkte, die in den Sekundärreaktionen gebildet werden, können durch eine Aufladung = Umkehrung des Prozesses = Elektrolyse nicht wieder zurückverwandelt werden. Bei der Aufladung des Leclanche´-Element würde die Elektrolyse von Wasser mit einer Wasserstoffgasentwicklung am Minus-Pol und Sauerstoffgasentwicklung am Plus-Pol ablaufen. Das entstehende Knallgasgemisch könnte dann zu einer Explosion führen. |
| update am 02.02.2021 zurück zur Hauptseite |