|
Versuchsergebnisse zum Versuch |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Im Gegensatz zur jetzigen Versuchsdurchführung wurde das Experiment vorher so durchgeführt, dass gleich beim 1. Tablettenstück das entstandene CO2-Volumen gemessen wurde. Das in 50 ml aqua dest. gelöste CO2 wurde mit einer Löslichkeit von 0,145 g/100 g Wasser in die Auswertung einbezogen (Wert aus "Datensammlung Chemie in SI-Einheiten". 3. erw. und neu bearb. Auflage, G.H.Aylward, T.J.V.Findlay, Wiley-VCH) Daten aus Schülerversuchen
Die Umsetzung der Versuchsdaten in ein Diagramm ergab drei Erkenntnisse:
1. Es gibt - wie nicht anders zu erwarten - eine Proportionalität zwischen der Masse des eingeworfenen Tablettenstücks und dem daraus entstehenden Volumen CO2. 2. Diese Proportionalität hat - was zu denken gab - ihren Ursprung nicht bei Null - kein NaHCO3, kein CO2 - , sondern entspricht eher der Geradengleichung y = a * x + m mit m als Achsenabschnitt. 3. Die Streubreite ist enorm: ca. 0,5 - 0,8 g Tablettenmasse entspricht 20 ml CO2; damit ist - selbst wenn man pro Versuchsreihe (Klasse) einzelne "Ausreiser" herausnimmt, die Ungenauigkeit ziemlich groß. Dabei kann man davon ausgehen, dass es weder an den Tabletten liegt (diese sind wohl ziemlich homogen gefertigt) noch an der Ableseungenauigkeit durch die Schüler. Diese Umstände brachten es mit sich, dass die Versuchsdurchführung so abgeändert wurde, wie jetzt in dem Arbeitsblatt beschrieben: mit einem 1. Tablettenstück von ca. 1 g wird die Lösung erst an CO2 gesättigt, das darüber hinaus entstandene Volumen CO2 wird im Kolbenprober aufgefangen und nachher in die Luft entlassen. Erst das 2. abgewogene Stück wird zur Auswertung verwendet. Das Wasser wird also nicht ausgetauscht! Daten aus dem Lehrerversuch:
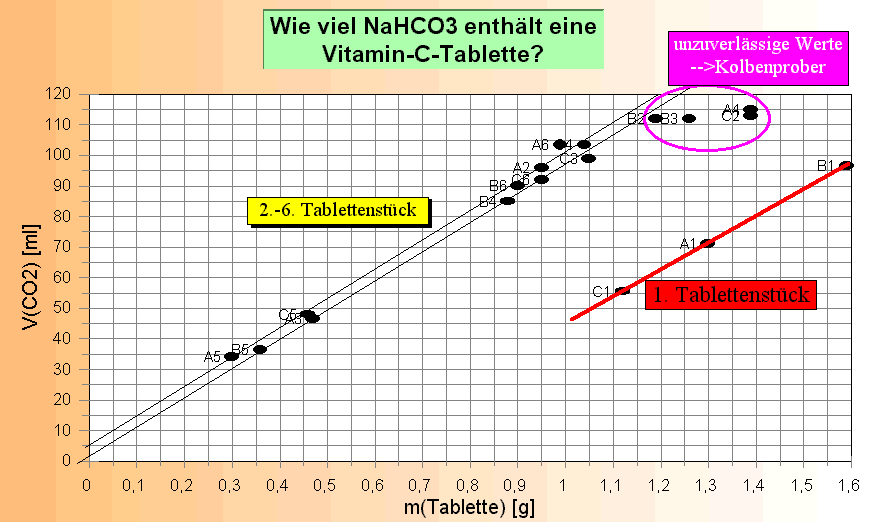
Legende:
"Vertrauenswürdige" Messwerte sind alle außer A1, B1 und C1 sowie den
Werten über 100 ml (Kolbenprober-Ungenauigkeit); Die Umsetzung der Versuchsdaten in ein Diagramm zeigt nun folgendes:
1. Wie zu erwarten, liegt das "1. Tablettenstück" bei allen drei Versuchsreihen (A1, B1 und C1) ähnlich wie die früheren Versuchsergebnisse und damit weit außerhalb der 2. - 6. Versuchsreihe. Das bedeutet, dass - wie oben gesagt - nach dem Einwurf des 1. Tablettenstücks das Wasser nicht mehr ausgetauscht werden darf. 2. Die Proportionalität ist wesentlich "enger" geworden, die Werte liegen in einem engen "Kanal" von ca. 40 mg Tablettenmasse für irgendeinen Wert Volumen CO2. 3. Der Ursprung liegt ziemlich genau bei Null. 4. Werte über 100 mL sind umso weniger verwertbar, je weiter sie von 100 mL weg liegen: die Genauigkeit und Dichtigkeit des Kolbenprobers setzt hier Grenzen in der Nutzung dieser Werte. 5. Rechnerische und graphische Auswertung ergeben ziemlich genau einen Wert von 1 g Tablette = 100 mL CO2. Damit kann nun die Versuchsplanung (wie schwer dürfen die Tablettenstücke sein?) und -Auswertung vereinfacht werden. Auswertung: m(Tablette) = 1 g; V(CO2) = 100 mL; Über die Umformung der Dichte r = m/V <==> m = r * V erhält man m(CO2) = 1,83 g/L * 0,1 L = 0,183 g; 1. Zwischenergebnis: Aus 1 g Tablettenstück erhält man 0,183 g CO2. Die Molaren Massen der weiteren beteiligten Komponenten sind: M(Citronensäure) = 192 g/mol; M(CO2) = 44 g/mol; M(NaHCO3) = 84 g/mol 2. Schritt: Reaktionsgleichung aufstellen C6H8O7(s) + 3 NaHCO3(s) ---> 3 CO2(g) + 3 H2O(l) + C6H5O7Na3(aq) Molare Massen: 192 g/mol 252 g/mol 132 g/mol 54 g/mol 258 g/mol Kontrolle: Summe linke Seite: 444 g/mol rechte Seite: 444 g/mol Nach der stöchiometrischen Gleichung entstehen aus 1 Mol
Citronensäure und 3 Molen Natriumhydrogencarbonat 3. Schritt: Die freigesetzte Stoffportion von m(CO2) = 0,183 g entspricht n(CO2) = m/M = 0,183 g/44 g/mol n(CO2) = 0,00416 mol. Damit beträgt nach der Reaktionsgleichung n(NaHCO3) auch 0,00416 mol. Umrechnung von n(NaHCO3) über m = n * M: m(NaHCO3) = 0,00416 mol * 84 g/mol = 0,349 g 4. Schritt: Bestimmung des Massenanteil w (NaHCO3) an der Tablette: Die Masse der Tabletteneinwaage betrug m(Tablette) = 1 g = 100%. Dann entsprechen 0,349 g NaHCO3 = 34,9 %, also ca. 35 %. Rückrechnung: Wenn nach der Reaktionsgleichung .... NaHCO3 ---> CO2 + ...., also ein Molverhältnis von 1 :1 gegeben ist, dann entsprechen 84 g/mol NaHCO3 eine Stoffmenge von 44 g/mol CO2. Besteht eine Tablette aus 35 % NaHCO3, reagieren also von einem Tablettenstück der Masse 1 g nur 0,35 g NaHCO3. Aus der Verhältnisgleichung x g CO2/44 g/mol CO2 = 0,35 g/84 g/mol NaHCO3 (zur Abwechslung mal anders!) bekommt man: x g = (0,35 g * 44 g/mol)/(84 g/mol) = 0,1833 g CO2. Durch Umrechnung über die Dichte ergibt das ein Volumen von 100 mL, also dem Wert, den man ja auch aus der Graphik gewonnen hat. Aus 1 g Tablette erhält man also 100 ml CO2, vorausgesetzt, die Lösung ist an CO2 gesättigt. Ist dies nicht der Fall, erhält man pro Gramm Tablette nur 45 ml CO2. Also gehen von den 100 ml entstehenden CO2 55 ml in Lösung. Damit beträgt die Löslichkeit an CO2 110 ml/100 g Wasser oder über die Dichte umgerechnet: 0,2 g CO2/100 g Wasser. Der in der "Datensammlung Chemie" veröffentlichte Wert liegt bei 0,169 g/100 g Wasser (20 °C) und 0,145 g CO2/100 g Wasser (25 °C) und ist damit wesentlich niedriger, was wohl darin liegt, dass die anderen Bestandteile (Citronensäure, Na-citronat, Zucker usw.) die Löslichkeit von CO2 erhöhen. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
update: zurück zur Hauptseite |